
En las últimas dos décadas la neurociencia computacional está experimentando un enorme desarrollo. Esto se puede ver en el número de publicaciones científicas que se producen en esta disciplina año a año.
En la gráfica se puede ver como hacia el año 2007 la disciplina comenzó un ascenso constante que no se ha detenido hasta nuestros días. Aunque a día de hoy el número de publicaciones por año no ha alcanzado lo de otras disciplinas, su ascenso es abundantemente creciente (Figura 1). Este incremento viene a reflejar el impacto que la neurociencia computacional está ejerciendo sobre diferentes ramas del saber en la neurociencia, desde la comprensión de los datos de neuroimagen, pasando por técnicas de intervención como la neuromodulación hasta llegar a influir en sistemas electrónicos y robótica.

En los últimos años son muchos los libros que se han publicado en esta disciplina, y también existen revistas científicas específicas sobre este campo (por ejemplo, PLoS Computational Biology, Frontiers in Computational Neuroscience, etc.)
Las primeras raíces científicas del campo se pueden rastrear hasta el trabajo de Louis Lapicque (1907). Desarrolló el modelo de neuronas Integrate and Fire, que todavía es popular hoy en día para estudios de redes neuronales clave debido a su simplicidad de comprensión y la posibilidad de implementación masiva. Con un enfoque diametralmente opuesto, los científicos Alan Lloyd Hodgkin y Andrew Huxley propusieron en el 1952 un modelo muy detallado, compuesto por un conjunto de ecuaciones diferenciales que aproxima las características eléctricas de células excitables como las neuronas (gracias al cual, recibieron el premio Nobel de Fisiología o Medicina en 1963).
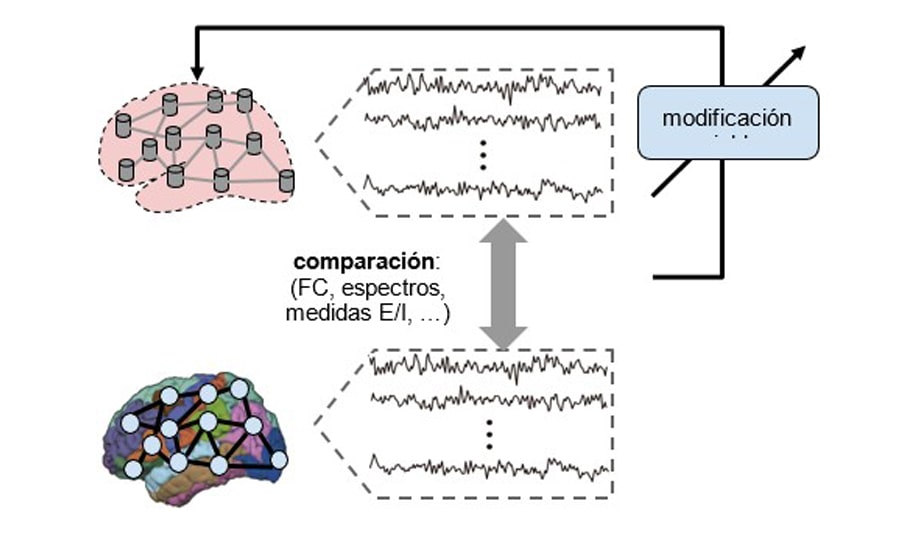
Uno de los escenarios de simulación más abordados en los trabajos de los últimos años consiste en el modelado de la condición a reposo, debido a la facilidad de llevar a cabo este tipo de estudio, y a la posibilidad de comparación con estudios similares que este protocolo simplificado conlleva (Figura 3).
Entre las distintas técnicas de simulación, las spiking neural networks (SNNs, o redes neuronales de impulso) permiten la simulación detallada de la actividad neuronal desde el nivel de neuronas individuales hasta poblaciones neuronales interconectadas. Con un enfoque diferente, los neural mass models (NMMs, o modelos de masas neuronales), son aptos para simular a nivel de población y no de neurona individual, pero permiten simulaciones de redes cerebrales más grandes (hasta en la escala del cerebro entero) con recursos de computación limitados.
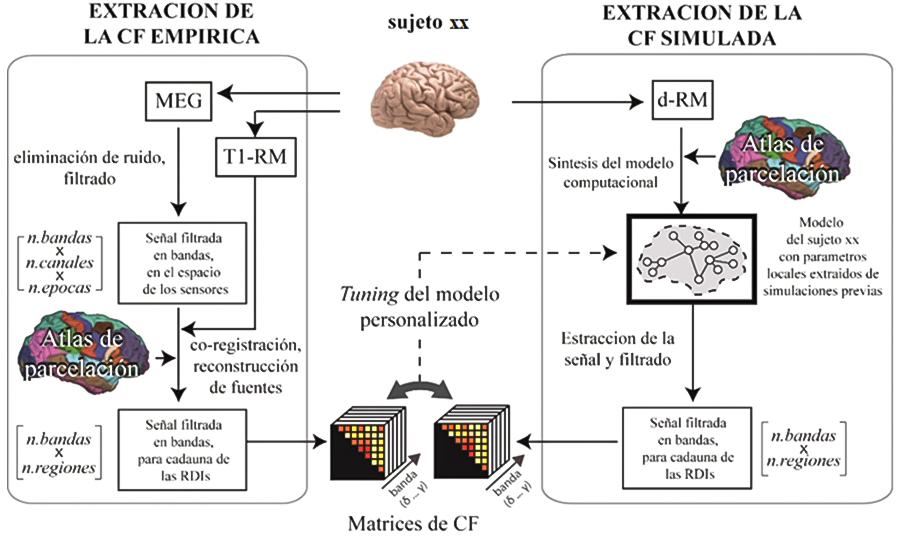
Las dos técnicas de simulación SNNs y NMMs son usadas de manera complementaria, para comprender y reproducir los mecanismos subyacentes a las enfermedades del sistema nervioso central, a través del estudio y reproducción de patrones típicos de conectividad funcional (CF), y su disrupción, obtenidos a partir de datos cerebrales reales (neurofisiológicos y estructurales).
Se pretende desarrollar un Instituto de Neurociencia Computacional de prestigio internacional que compita con los mejores centros extranjeros y nacionales. Nuestra originalidad se basará en tres temáticas fundamentales. Focalizarnos en las patologías del neurodesarrollo, en la investigación de las claves de la inteligencia humana y en las intervenciones de neuromodulación. Estos tres temas no han sido todavía objeto de grandes propuestas y por tanto este Instituto podría ser pionero y generar liderazgo en estas temáticas. Además, se pretende generar modelos individualizados y que por tanto puedan servir en el escenario clínico. La inspiración de modelos de neuro-robótica estará también en el horizonte de este Instituto, aunque por su complejidad va a requerir de la colaboración con otros investigadores dedicados a la mecánica y robótica.
Se proponen las siguientes líneas de investigación:
El Instituto está dotado de tecnología avanzada de computación de datos (CPUs y GPUs) y acceso a cluster de procesamiento. Esto facilita los procesos de análisis de datos y la ejecución de los objetivos. Así mismo, se disponen de tecnologías de registro de la actividad cerebral y de neuromodulación, tanto para poder evaluar las hipótesis generadas en los modelos computacionales, como para generar, a partir del análisis de los datos reales, hipótesis que se someterán a validación mediante los modelos computacionales.
El objetivo final del desarrollo de nuestros modelos computacionales es el de encontrar la configuración y la duración óptimas de la estimulación a realizar en sujetos patológicos, para restaurar un funcionamiento de la red cerebral lo más parecido al caso de personas sanas. A este propósito, las intervenciones diseñadas in-silico se implementarán en los sujetos reales a través de estimulación cerebral no invasiva (NIBS). Los avances recientes en este campo han proporcionado dispositivos accesibles para una multitud de propósitos de investigación y han hecho que las técnicas de neuromodulación sean más seguras. En este sentido, la literatura científica documenta que la estimulación eléctrica transcraneal (tES) nos brinda la posibilidad de modular eficazmente la actividad cerebral y, por lo tanto, de influir en los procesos cognitivos.
Como mencionado anteriormente, los dos enfoques utilizados hoy en día para la simulación de actividad cerebral consisten en las spiking neural networks, donde se emplea un set de ecuaciones para describir la actividad de cada neurona individual a lo largo del tiempo, y las neural mass models, donde se emplea un número reducido de ecuaciones para describir la actividad de toda una población a lo largo del tiempo. Las dos técnicas de simulación son usadas de manera complementaria, para comprender y reproducir los mecanismos subyacentes a las enfermedades del sistema nervioso central, a través del estudio y reproducción de patrones típicos de CF, y su disrupción, obtenidos a partir de datos cerebrales reales (neurofisiológicos y estructurales).
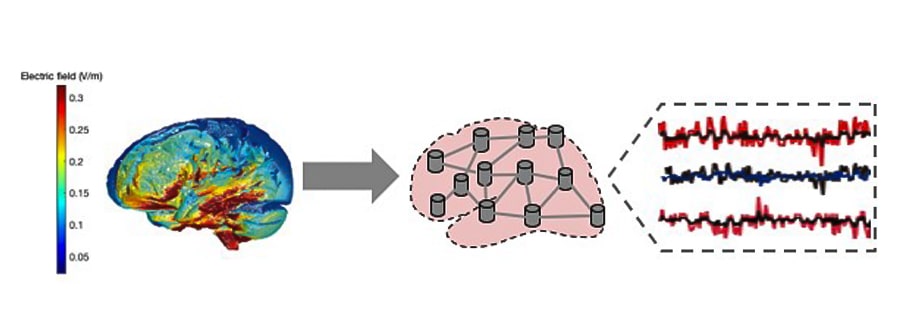
Podemos pensar a nuestro cerebro como un sistema de procesamiento de información electroquímica. Cuando aplicamos tES utilizando electrodos en el cuero cabelludo, inducimos en la cabeza unos débiles campos eléctricos capaces de alterar los potenciales de membrana de las neuronas de la corteza cerebral. El efecto es especialmente eficaz en las llamadas células piramidales (un tipo de neuronas alargadas, alineadas entre ellas, y perpendiculares a la superficie de la corteza) y depende de la orientación relativa del vector del campo eléctrico (es decir, el vector E) con respecto a la orientación de las células piramidales. Todo esto es capaz de modificar la forma en que algunas partes del cerebro procesan la información. El cambio en el potencial de membrana es el mecanismo fundamental detrás de la tES, y numerosos son los estudios de investigación que lo cuantifican (Ruffini et al. 2013).
Para poder simular un cerebro bajo estimulación, normalmente se utilizan dos tipos de modelos computacionales: los modelos de propagación de corriente, que están diseñados para analizar, predecir y regular los campos eléctricos generados en el cerebro durante la estimulación, teniendo en cuenta factores como la conductividad y las formas de los tejidos cerebrales, y la configuración de los electrodos o bobinas utilizados para la estimulación. Por otro lado, los modelos de activación neuronal se centran en comprender y predecir cómo se modifica la actividad cerebral, teniendo en cuenta las características biofísicas de las neuronas. En conjunto, estos modelos computacionales proporcionan información valiosa sobre los efectos y mecanismos de la estimulación cerebral.
Para los modelos de propagación de corriente usamos imágenes de resonancia magnética (MRI-T1) de los participantes para segmentar los tejidos cerebrales y generar un mallado volumétrico personalizado, que nos permite estimar la propagación del campo eléctrico a través del cerebro bajo estimulación en cada punto del cerebro (Huang et al. 2018; Merlet et al. 2013). Por otra parte, se obtiene la información sobre la orientación del eje neuronal de las células piramidales utilizando un mallado superficial de la superficie de límite entre la materia blanca y la materia gris.
Todo esto permite calcular los valores de las proyecciones del campo eléctrico en la dirección normal con respecto a cada porción de superficie. En los casos en que los campos estén alineados con la dirección ortodrómica (desde el ápice hacia el axón) de las neuronas, se producirá una variación positiva del potencial de membrana, a diferencia de aquellos en dirección antidrómica, que producirán una variación negativa del potencial de membrana (Merlet et al. 2013). Para cada sujeto, las proyecciones de los campos eléctricos se pueden agrupar obteniendo el efecto sobre cada una de las regiones. Como punto final se introducen estos datos en los modelos de activación neuronal (basados en los enfoques SNN o NMM ya comentados anteriormente) y se realiza un procedimiento de calibración para encontrar el factor de escala que maximiza la coincidencia con las observaciones empíricas. A este punto tenemos todos los ingredientes para una reproducción in-silico del cerebro bajo estimulación (Figura 4).

Los efectos clínicamente relevantes de la tES están relacionados con cambios en la excitabilidad cortical y la conectividad del cerebro. Es interesante destacar que, además de inducir efectos temporales, las técnicas de estimulación cerebral no invasiva son capaces de interactuar con los mecanismos naturales de plasticidad, provocando efectos duraderos (Huang et al. 2017; Frase et al. 2021; Nitsche and Paulus 2000). El mecanismo a la base de la permanencia de estas modificaciones puede encontrarse en un importante fenómeno descrito por Donald Hebb: considerando un par de neuronas conectadas a través de una sinapsis, si la neurona presináptica participa de manera persistente en hacer que la neurona postsináptica dispare, la conexión entre ellas se fortalecerá gradualmente. Y viceversa, si la actividad de estas dos neuronas no está relacionada causalmente, se desconectarán gradualmente. Es la modificación entre las conexiones neuronales que hace que los efectos perduren después de la estimulación. Los efectos provocados por estas técnicas dependen de los parámetros de la estimulación, que incluyen intensidad, duración y frecuencia.
Modelado del trastorno por déficit de atención e hiperactividad (TDAH)
Nuestro modelado multiescala proporciona una ocasión única para interpretar los mecanismos propios de esta enfermedad, y comprender cuáles son las variables que se pueden modular en sujetos reales, y cómo hacerlo, para restaurar un funcionamiento de la red cerebral lo más parecido al caso de personas sanas. Estamos desarrollando las primeras 2 fases de esta línea, que describimos abajo, detallando algunas características de nuestro enfoque que merece la pena destacar.
FASE 1 – Reproducción in-silico de dos grupos de sujetos reales: grupo TDAH y grupo control

FASE 2 – Diseño y optimización de la estimulación cerebral transcraneal para inducir el equilibrio óptimo y analizar la evolución de la red tras la estimulación
Aunque las técnicas de estimulación transcraneal parecen ser prometedoras para mejorar los déficits de TDAH, aún no se consigue determinar con precisión la utilidad clínica. Las regiones corticales involucradas en la fisiopatología del TDAH, los parámetros de estimulación (p. ej., intensidad, duración, polaridad y tamaño del electrodo) y los tipos de síntomas/déficit son determinantes potenciales de la eficacia de la estimulación transcraneal en el TDAH (Salehinejad et al. 2020).
Nuestros modelos computacionales nos permiten encontrar la configuración y la duración óptimas de la estimulación a realizar, y a la vez predecir si los resultados han sido alcanzados. Hay que notar que, a diferencia de las NMM, las SNN permiten modelar mejor la heterogeneidad de estimulación en la manta cortical, consecuencia de la orientación de la materia gris respecto a las líneas del campo eléctrico inducido en el cerebro (Cabrera-Álvarez et al. 2023), y evaluar la acción de la plasticidad sináptica sobre la evolución de los parámetros de la red después de la estimulación (Figura 7).
Bruining, Hilgo, Richard Hardstone, Erika L. Juarez-Martinez, Jan Sprengers, Arthur-Ervin Avramiea, Sonja Simpraga, Simon J. Houtman, et al. 2020. “Measurement of Excitation-Inhibition Ratio in Autism Spectrum Disorder Using Critical Brain Dynamics.” Scientific Reports 10 (1): 9195.
Cabrera-Álvarez, Jesús, Jaime Sánchez-Claros, Martín Carrasco-Gómez, Alberto Del Cerro-León, Carlos J. Gómez-Ariza, Fernando Maestú, Claudio R. Mirasso, and Gianluca Susi. 2023. “Understanding the Effects of Cortical Gyrification in tACS: Insights from Experiments and Computational Models.” Frontiers in Neuroscience 17 (August): 1223950.
Frase, Lukas, Lydia Mertens, Arno Krahl, Kriti Bhatia, Bernd Feige, Sven P. Heinrich, Stefan Vestring, et al. 2021. “Transcranial Direct Current Stimulation Induces Long-Term Potentiation-like Plasticity in the Human Visual Cortex.” Translational Psychiatry 11 (1): 17.
Huang, Ying-Zu, Ming-Kue Lu, Andrea Antal, Joseph Classen, Michael Nitsche, Ulf Ziemann, Michael Ridding, et al. 2017. “Plasticity Induced by Non-Invasive Transcranial Brain Stimulation: A Position Paper.” Clinical Neurophysiology: Official Journal of the International Federation of Clinical Neurophysiology 128 (11): 2318–29.
Huang, Yu, Abhishek Datta, Marom Bikson, and Lucas C. Parra. 2018. “ROAST: An Open-Source, Fully-Automated, Realistic Volumetric-Approach-Based Simulator For TES.” Conference Proceedings: … Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Conference 2018 (July): 3072–75.
Iravani, Behzad, Artin Arshamian, Peter Fransson, and Neda Kaboodvand. 2021. “Whole-Brain Modelling of Resting State fMRI Differentiates ADHD Subtypes and Facilitates Stratified Neuro-Stimulation Therapy.” NeuroImage 231 (May): 117844.
Karalunas, Sarah L., Brendan D. Ostlund, Brittany R. Alperin, Mckenzie Figuracion, Hanna C. Gustafsson, Erika Michiko Deming, Dan Foti, et al. 2022. “Electroencephalogram Aperiodic Power Spectral Slope Can Be Reliably Measured and Predicts ADHD Risk in Early Development.” Developmental Psychobiology 64 (3): e22228.
Merlet, Isabelle, Gwénaël Birot, Ricardo Salvador, Behnam Molaee-Ardekani, Abeye Mekonnen, Aureli Soria-Frish, Giulio Ruffini, Pedro C. Miranda, and Fabrice Wendling. 2013. “From Oscillatory Transcranial Current Stimulation to Scalp EEG Changes: A Biophysical and Physiological Modeling Study.” PloS One 8 (2): e57330.
Nitsche, M. A., and W. Paulus. 2000. “Excitability Changes Induced in the Human Motor Cortex by Weak Transcranial Direct Current Stimulation.” The Journal of Physiology 527 Pt 3 (Pt 3): 633–39.
Potjans, Tobias C., and Markus Diesmann. 2014. “The Cell-Type Specific Cortical Microcircuit: Relating Structure and Activity in a Full-Scale Spiking Network Model.” Cerebral Cortex 24 (3): 785–806.
Ruffini, Giulio, Fabrice Wendling, Isabelle Merlet, Behnam Molaee-Ardekani, Abeye Mekonnen, Ricardo Salvador, Aureli Soria-Frisch, Carles Grau, Stephen Dunne, and Pedro C. Miranda. 2013. “Transcranial Current Brain Stimulation (tCS): Models and Technologies.” IEEE Transactions on Neural Systems and Rehabilitation Engineering: A Publication of the IEEE Engineering in Medicine and Biology Society 21 (3): 333–45.
Salehinejad, Mohammad Ali, Vahid Nejati, Mohsen Mosayebi-Samani, Ali Mohammadi, Miles Wischnewski, Min-Fang Kuo, Alessio Avenanti, Carmelo M. Vicario, and
Michael A. Nitsche. 2020. “Transcranial Direct Current Stimulation in ADHD: A Systematic Review of Efficacy, Safety, and Protocol-Induced Electrical Field Modeling Results.” Neuroscience Bulletin 36 (10): 1191–1212.
Simola, Jaana, Alexander Zhigalov, Isabel Morales-Muñoz, J. Matias Palva, and Satu Palva. 2017. “Critical Dynamics of Endogenous Fluctuations Predict Cognitive Flexibility in the Go/NoGo Task.” Scientific Reports 7 (1): 2909.
Susi, Gianluca, Pilar Garcés, Emanuele Paracone, Alessandro Cristini, Mario Salerno, Fernando Maestú, and Ernesto Pereda. 2021. “FNS Allows Efficient Event-Driven Spiking Neural Network Simulations Based on a Neuron Model Supporting Spike Latency.” Scientific Reports 11 (1): 12160.
Cabrera-Álvarez, Jesus, Jaime Sánchez-Claros, Martín Carrasco-Gómez, Alberto del Cerro-León, Carlos J. Gomez-Ariza, Fernando Maestú, Claudio Mirasso, Gianluca Susi “Understanding the Effects of Cortical Gyrification in tACS: Insights from Experiments and Computational Models”. Frontiers in Neuroscience (In publication)